Прививка от рака: умная нановакцина прошла первые испытания на мышах и тканях человека
Вакцина, нацеленная на рак головы и шеи, вызываемый вирусом папилломы человека (ВПЧ), показала многообещающие результаты в лабораторных исследованиях на человеческих тканях и мышах. Если её эффективность подтвердится в клинических испытаниях, терапевтический укол сможет работать в связке с классическими методами лечения — хирургией, облучением и химиотерапией. А сама конструкция вакцины может подсказать учёным, как создавать более совершенные препараты и против других болезней.
ВПЧ известен прежде всего как причина рака шейки матки, но он вызывает и другие виды опухолей, включая орофарингеальный рак (рак горла). В США около 70% таких случаев связаны именно с ВПЧ. Хотя существует более 100 штаммов вируса, лишь 12 из них считаются онкогенными «высокого риска», и почти все случаи ВПЧ-положительного рака горла вызваны штаммом 16.
Вакцина «Гардасил 9» эффективно предотвращает заражение ВПЧ и тем самым снижает риск развития рака в будущем. Но тем, у кого опухоль уже сформировалась, по-прежнему приходится полагаться на хирургию, лучевую и химиотерапию. Противораковая вакцина способна усилить действие этих методов: она обучает иммунную систему самостоятельно распознавать и уничтожать опухолевые клетки.
Учёные сконструировали вакцину с уникальной архитектурой. Как и профилактические прививки, терапевтические вакцины «знакомят» иммунитет с определёнными белками-мишенями (в данном случае — с белком, который присутствует на поверхности ВПЧ-положительных опухолей). В их состав также входят адъюванты — вещества, усиливающие иммунный ответ. Но, в отличие от профилактических, лечебные вакцины применяются уже после того, как болезнь возникла, и призваны не допустить её возвращения.
Исследование, опубликованное в среду (11 февраля) в журнале Science Advances, показало: в лабораторных моделях ВПЧ-положительного рака головы и шеи новая вакцина замедляла рост опухолей у мышей и увеличивала продолжительность их жизни.
Иммунитет чувствует форму
Доктор Эзра Коэн, специалист по раку головы и шеи из Калифорнийского университета в Сан-Диего, не участвовавший в работе, называет подход многообещающим. «Можно представить себе комбинированную стратегию: сначала вылечить пациента стандартными методами, а затем вакциной закрепить результат и предотвратить рецидив», — говорит он. Однако Коэн напоминает: успехи на мышах и в изолированных тканях далеко не всегда переносятся в клинику. «Настоящая проверка — на людях, — подчёркивает он. — Но убедительные доклинические данные, как в этой работе, серьёзно повышают шансы на успех в испытаниях».
Главная изюминка вакцины — не состав, а структура.
«Ключевой вывод: то, как организована вакцина, имеет огромное значение, — поясняет Коэн. — Успешная вакцинация — это не просто правильный выбор белка-мишени. Это ещё и правильное расположение этого белка относительно других компонентов».
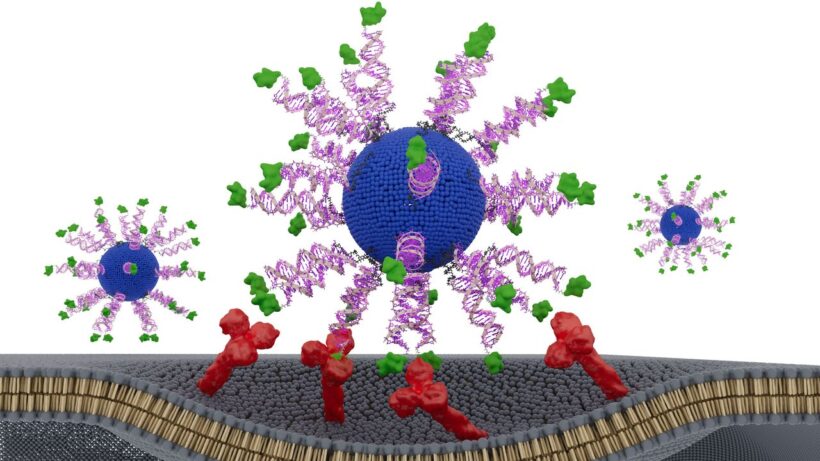
В основе разработки лежат сферические нуклеиновые кислоты (СНК) — глобулы из ДНК, которые проникают в иммунные клетки гораздо эффективнее, чем линейные молекулы. Каждая такая наночастица состоит из жирового ядра, окружённого адъювантом и фрагментом вирусного белка, взятого из опухолевых клеток. Адъювант имитирует бактериальную ДНК — иммунитет распознаёт её как «чужую» и мгновенно активируется.
Исследователи испытали три варианта вакцины, меняя только одно — положение вирусного фрагмента. В первой версии он был спрятан внутрь наночастицы. В двух других — вынесен на поверхность и закреплён за разные концы белковой цепочки (N-конец и C-конец).
Версия с креплением за N-конец вызвала самый мощный иммунный ответ. Т-киллеры — клетки, уничтожающие инфицированные и раковые клетки — производили в восемь раз больше интерферона-гамма, ключевого сигнального белка, подавляющего опухоли. Соответственно, они гораздо эффективнее убивали ВПЧ-положительные раковые клетки.
У мышей с ВПЧ-ассоциированными опухолями N-концевая вакцина значительно замедляла рост новообразований. А в тестах на образцах, взятых у реальных пациентов, она уничтожала в два-три раза больше раковых клеток, чем две другие версии.
«Эффект достигнут не за счёт новых ингредиентов и не за счёт увеличения дозы, — подчёркивает соавтор исследования доктор Йохен Лорч, онколог и руководитель программы по раку головы и шеи Northwestern Medicine. — Мы просто предъявили те же самые компоненты более разумным способом».
«Иммунная система чувствительна к геометрии молекул, — добавляет Лорч. — Оптимизировав способ крепления антигена к СНК, мы помогли иммунным клеткам обрабатывать его гораздо эффективнее».
Вторая жизнь для старых вакцин
Чад Миркин, соавтор исследования, изобретатель сферических нуклеиновых кислот и директор Международного института нанотехнологий при Северо-Западном университете, смотрит в будущее с оптимизмом. Он надеется, что тот же подход позволит реанимировать многообещающие, но провалившиеся вакцины прошлого.
«Этот метод способен изменить сам подход к разработке вакцин, — заявил Миркин. — Возможно, мы отказывались от идеально работающих компонентов только потому, что они были предъявлены иммунитету в неправильной конфигурации. Теперь мы можем вернуться к ним, пересобрать — и превратить в мощные лекарства».
От мышей к людям — путь длиною в годы
Несмотря на восторг учёных, путь до аптеки предстоит долгий. Доклинические исследования — лишь первый шаг. Прежде чем вакцина попадёт в клинику, её ждут несколько фаз клинических испытаний на людях. Первая фаза проверит безопасность, вторая — эффективность на небольших группах пациентов, третья — преимущества перед существующими методами лечения.
Но именно такие работы, меняющие не состав, а архитектуру, сегодня считаются одним из самых перспективных направлений иммуноонкологии. Мы привыкли думать, что лекарство — это «что». Оказывается, не менее важно «как». Иммунитет, как тонкий инструмент, реагирует не только на текст послания, но и на то, каким шрифтом оно набрано.
Статья носит исключительно информационный характер и не является медицинской рекомендацией.