Седина как щит: как организм жертвует цветом волос, защищаясь от рака
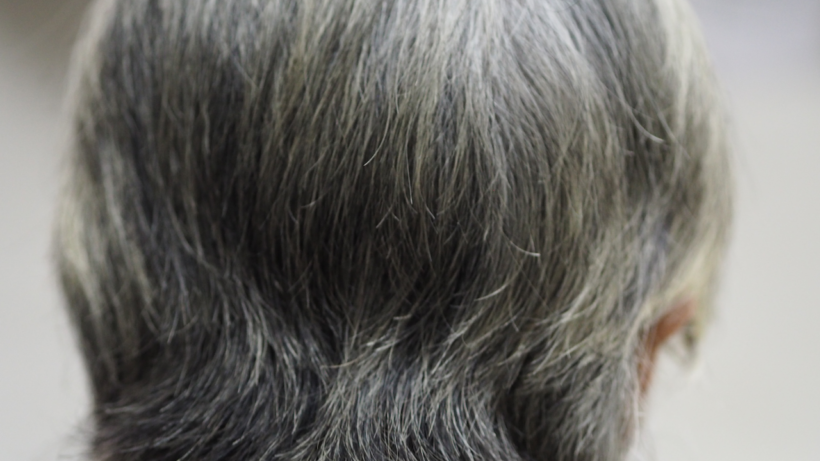
Поседение волос может быть признаком того, что организм эффективно защищает себя от рака, предполагает новое исследование.
Как выяснили учёные, такие факторы, провоцирующие онкологические заболевания, как ультрафиолетовое излучение или определённые химические вещества, активируют естественный защитный механизм. Этот механизм приводит к преждевременной седине, но одновременно снижает вероятность развития рака.
Исследователи проследили судьбу стволовых клеток, отвечающих за выработку пигмента, который придаёт волосам цвет. Эксперименты на мышах показали, что в ответ на повреждение ДНК эти клетки либо прекращали рост и деление (что приводило к седине), либо начинали бесконтрольно размножаться, в конечном итоге образуя опухоль.
Результаты работы, опубликованные в октябре в журнале Nature Cell Biology, подчёркивают важность подобных защитных механизмов, которые развиваются с возрастом как средство против повреждения ДНК и болезней.
Седина в обмен на защиту
Здоровый рост волос зависит от популяции стволовых клеток, которые постоянно обновляются внутри волосяного фолликула. Крошечный «карман» в фолликуле содержит запас меланоцитных стволовых клеток — предшественников клеток, производящих пигмент меланин, окрашивающий волосы.
«В каждом цикле роста волос эти меланоцитные стволовые клетки делятся и производят зрелые, дифференцированные клетки, — объясняет клеточный биолог Дот Беннетт из Университета Лондона, не участвовавшая в исследовании. — Они мигрируют к основанию фолликула и начинают вырабатывать пигмент, который поступает в растущий волос».
Седина появляется, когда эти клетки больше не могут производить достаточно пигмента для равномерного окрашивания каждой волосинки.
«Это своего рода истощение, называемое клеточным старением (сенесценцией), — говорит Беннетт. — Это ограничение на общее количество делений, которое может пройти клетка, и, по-видимому, это антираковый механизм, предотвращающий бесконтрольное распространение случайных генетических ошибок, накопленных со временем».
Достигнув этой «контрольной точки», меланоцитные стволовые клетки перестают делиться, и фолликул лишается источника пигмента. Обычно это происходит в старости, когда стволовые клетки естественным образом достигают предела. Однако профессор Эми Нисимура из Токийского университета и её коллег интересовало, как этот же механизм срабатывает в ответ на повреждение ДНК — ключевой триггер развития рака.
В исследованиях на мышах команда использовала комбинацию методов, чтобы отследить судьбу отдельных меланоцитных стволовых клеток на протяжении цикла роста волос после воздействия вредных условий, включая ионизирующее излучение и канцерогенные соединения. Интригующим открытием стало то, что тип повреждения определял реакцию клетки.
Разные угрозы — разная судьба
Ионизирующее излучение заставляло стволовые клетки дифференцироваться и созревать, в конечном итоге активируя биохимический путь, ответственный за клеточное старение. В результате запасы меланоцитных стволовых клеток быстро истощались в течение цикла, прекращая производство новых зрелых пигментных клеток и приводя к седине.
При этом, по сути выключая деление клеток, этот путь старения предотвращал передачу мутировавшей ДНК новому поколению клеток, тем самым снижая вероятность образования этими клетками раковых опухолей.
Воздействие же химических канцерогенов, таких как ДМБА (широко используемое в онкологических исследованиях вещество), по-видимому, обходило этот защитный механизм. Вместо активации старения оно запускало конкурирующий клеточный путь.
В исследованиях на мышах эта альтернативная химическая последовательность блокировала клеточное старение. Это позволяло волосяным фолликулам сохранять резервы стволовых клеток и способность производить пигмент даже после повреждения ДНК. Это означало, что волосы сохраняли цвет, но в долгосрочной перспективе неконтролируемая репликация повреждённой ДНК приводила к образованию опухолей и раку.
«Эти находки показывают, что одна и та же популяция стволовых клеток может встретить противоположную судьбу в зависимости от типа стресса, — говорит ведущий автор исследования Эми Нисимура. — Это позволяет взглянуть на поседение волос и меланому не как на не связанные между собой события, а как на разные исходы реакции стволовых клеток на стресс».
Следующим шагом, отмечает Дот Беннетт, будет перенос этого понимания на человеческие волосяные фолликулы, чтобы выяснить, применимы ли наблюдения, сделанные на мышах, к людям.
Перспективы и вопросы
Данное открытие открывает новые горизонты не только в фундаментальной биологии старения и онкологии, но и в практической медицине. Понимание точных молекулярных «переключателей» между путём безопасного старения (с приводящей к нему сединой) и путём злокачественного перерождения может в будущем лечь в основу новых профилактических стратегий. Теоретически, научившись мягко стимулировать механизм клеточного старения в уязвимых тканях, можно было бы предотвращать развитие некоторых видов рака.
Однако остаётся множество вопросов. Насколько универсален этот механизм для других типов стволовых клеток организма? Как на него влияют генетическая предрасположенность, гормональный фон или хронические воспалительные процессы? И, главное, является ли ранняя седина у конкретного человека однозначным маркером активированной противораковой защиты, или же это может быть следствием других факторов? Для ответов потребуются масштабные долгосрочные исследования с участием людей.
Таким образом, седина, долгое время считавшаяся лишь косметическим признаком увядания, теперь предстаёт в новом свете — как возможное свидетельство напряжённой и эффективной работы внутренних защитных систем, ценой которой для организма становится потеря цвета волос.
Данная статья предназначена исключительно для информационных целей и не является медицинской рекомендацией.